Перевод / пересказ англоязычных публикаций за последнее десятилетие с упором на свежие данные.
Ранее я уже делал подобный материал по одной статье. Но она была довольно старой, так что я решил поднять новейшие исследования на этот счёт. И немного увлёкся (гиперфокус?)… Помимо данных о взаимосвязи есть очень много интересной, но сложной, новой информации о каждом расстройстве в отдельности.
Может присутствовать психофобная лексика (как в самих научных исследованиях)
Проблема взаимосвязи СДВГ и РАС является актуальной для современной науки. Это очень часто встречаемые расстройства, которые часто коморбидны друг другу. Стоит отметить, что процент распространённости этих расстройств с годами рос. По данным Центров по контролю и профилактике заболеваний США если процент детей с СДВГ составлял в 1997 году 6.1%, то к 2016 году он составил уже 10.2% [1]. И с тех пор держится на этом уровне [2]. Более того, если брать детей в возрасте от 12 до 17 лет, то процент станет ещё больше — 13.6. В случае аутизма, по данным ЦКЗ рост наблюдался с 0.66% в 2000 году до 2.7% в 2020 [3]. То есть каждый 36-ой ребёнок в США является носителем РАС. А СДВГ соответственно — каждый десятый.
Очень интересной особенностью этих расстройств является то, что они очень часто наблюдаются вместе. Исследования показывают, что до 40 и даже 70 процентов людей с РАС также имеют коморбидное СДВГ [4]. Исследования СДВГ в свою очередь показывают, что до 70% людей с СДВГ проявляют симптомы, похожие на симптомы РАС [5].

Такие симптомы как гиперактивность, невнимательность, задержка речи, раздражительность, проблемы в общении со сверстниками и гиперфиксация на отдельных предметах или интересах характерны и для СДВГ, и для РАС.
Задачей данного очерка является анализ материалов на тему коморбидности и взаимосвязи СДВГ и РАС. До 2013 года в США по DSM-IV было принято считать, что это различные расстройства, которые не могут существовать одновременно. Один диагноз полностью исключал другой. Также было и с МКБ10. Считалось, что одно расстройство лишь копирует симптомы другого.
После 2013 года и введения DSM-V ситуация изменилась. Теперь полагают, что оба этих расстройства могут быть коморбидны. Увеличилось количество исследований, изучающих вопрос взаимосвязи данных расстройств. Была даже выдвинута гипотеза, что СДВГ и РАС являются по сути одним расстройством с разными проявлениями [6]. Данная статья стремится сделать обзор состояния науки по данному вопросу на текущий момент.
Генетика аутизма
За последние годы наука смогла существенно продвинуться в определении генетических основ возникновения СДВГ и РАС. В статье 2018 года «Прогресс в изучении генетики расстройств аутистического спектра» говорится о том, что генетическая основа расстройств аутистического спектра в настоящее время хорошо изучена, благодаря наличию высокопроизводительных микрочипов и платформ для секвенирования были достигнуты значительные успехи в понимании генетических факторов риска. [7].
В статье «Достижения в области генетики аутизма» пишется: «Теперь мы знаем, что аутизм является одним из наиболее наследуемых расстройств с незначительным общим вкладом окружающей среды. Недавние открытия также показывают, что редкие варианты с большим эффектом, а также распространенные варианты генов с малым эффектом – все они способствуют росту риска развития аутизма. Эти открытия бросают вызов традиционным диагностическим границам и подчеркивают огромную неоднородность аутизма» [8].
Важным моментом в статье «Достижения в области генетики аутизма» является упоминание того, что первое исследование аутизма на близнецах, проведенное Фолштейном и Раттером (Folstein and Rutter, 1977), было новаторским, поскольку оно ясно показало преимущественно генетическую природу аутизма. Последний, на момент написания статьи, мета-анализ всех опубликованных исследований аутизма на близнецах, проведеннй Тиком и его коллегами (Tick et al., 2016), также дал высокую оценку наследуемости в 64-91% и не выявил существенного вклада окружающей среды. Исследование 2019 года подтверждает такую точку зрения [9].

В статье также говорится о коморбидности РАС и СДВГ. Отмечается, что сейчас общепризнано, что аутизм показывает высокий уровень сопутствующей патологии, и популяционные исследования близнецов неизменно показывают, что черты аутизма демонстрируют сильную генетическую корреляцию с другими особенностями развития нервной системы и диагнозами (Thapar and Rutter 2015). Исследование близнецов, проведённое в Швеции, показало, что аутизм не только в высокой степени наследуем, но и что три четверти его возможных генов пересекается с СДВГ и что генетические факторы также влияют на коморбидность аутизма с моторными расстройствами и тиками (Lichtenstein et al. 2010). Последующий анализ семейных данных Шведского регистра дополнительно выявил важные связи между аутизмом и СДВГ (Ghirardi et al., 2017). Это исследование включало 899 654 человека в Швеции с диагнозами, зарегистрированными клиническими службами на национальном уровне. Авторы заметили, что люди с аутизмом были подвержены более высокому риску развития СДВГ по сравнению с людьми, у которых аутизма не было.
Генетика СДВГ
В 2018 году в Американском журнале психиатрии вышла статья «Открытия в области генетики СДВГ в 21 веке: Новые открытия и их последствия» [10]. Это обзорная статья научных достижений в этой области за предыдущие 5 лет, то есть с 2013 года. В ней говорится, что 21 век стал свидетелем открытия множества редких и распространенных вариантов генов, связанных с синдромом дефицита внимания и гиперактивности (СДВГ). А также, что недавние открытия свидетельствуют о сильном генетическом совпадении между СДВГ и расстройствами аутистического спектра (РАС), а также умственной отсталостью.
В статье отмечается, что также как и РАС, СДВГ является наследуемым расстройством. Его наследуемость по разным оценкам составляет от 60 до 90 процентов. Недавние генетические открытия подчеркивают сильное совпадение между СДВГ, РАС и умственной отсталостью. С точки зрения редких мутаций, до сих пор не было возможности провести различение между СДВГ и РАС, поэтому отмена предыдущих диагностических критериев, исключающих СДВГ при наличии РАС стала долгожданным изменением в DSM-5. Однако клинические особенности и методы лечения этих расстройств сильно различаются.
Общая генетика
За последние годы появились исследования генетической взаимосвязи СДВГ и РАС. В Италии в 2021 году было проведено исследование «Полиморфизмы рецепторов DRD1 и DRD2: генетическая нейромодуляция дофаминергической системы как фактор риска РАС, СДВГ и коморбидности РАС/СДВГ» [11]. Авторы исследования пишут, что дофаминергическая система – одна из наиболее важных нейромодуляторных систем, отвечающих за сложные функции, которые нарушаются при СДВГ, РАС и их коморбидном течении. Коллектив автор полагает, что оба расстройства могут иметь общие нейробиологические пути, вовлекающие дофаминергическая систему. Это исследование показало, что наличие специфических SNP DRD1 /DRD2 может увеличить риск развития РАС, СДВГ и их комбинации.

В 2021 году было также проведено ещё одно исследование генетических факторов развития СДВГ и РАС. Коллектив авторов из Гонконга провёл исследование «Генетический параллелизм между СДВГ и РАС в гене SHANK2» [12]. В этом исследовании приняли участие 298 мальчиков с СДВГ, 134 мальчика с РАС, 109 мальчиков с СДВГ и РАС вместе, а также 232 мальчика с типичным развитием в качестве контрольной группы. Они были в возрасте от 6 до 11 лет. Были выявлены существенные доказательства связи заболеваемости обоими расстройствами с SNP SHANK2. Авторы делают вывод, что SHANK2 можно рассматривать как потенциальный плейотропный ген, лежащий в основе генетического параллелизма СДВГ и РАС. Плейотропия – это явление, когда один ген может обуславливать несколько признаков.
Много раньше, в 2014 году, в журнале Американской Академии детской и подростковой психиатрии было опубликовано крупное исследование «Биологическое пересечение СДВГ и РАС: данные на основе вариаций числа копий» 9 [13]. Вариация числа копий (Copy number variation, CNV) — вид генетического полиморфизма, к которому относят различия индивидуальных геномов по числу копий хромосомных сегментов размером от одной тысячи до нескольких миллионов пар оснований. Учёные сравнили данные CNV от 727 детей с СДВГ и 5081 детей из контрольной группы с данными от 996 человек с РАС и контрольной группой из 1287 человек. Результаты показывают, что биологические пути, на которые влияют CNV при СДВГ, пересекаются с теми, на которые влияют CNV при РАС, в большей степени, чем можно было бы ожидать случайно. Результаты этого исследования указывают на наличие значительного совпадения общих биологических процессов, нарушаемых большими редкими CNV у детей с этими двумя состояниями развития нервной системы.

В 2017 году в журнале “Translational Psychiatry” («Трансляционная психиатрия») была опубликована статья «Наборы глутаматергических и ГАМКергических генов при синдроме дефицита внимания/гиперактивности: связь с пересекающимися признаками при СДВГ и аутизме» 10 [14]. Глутамат и ГАМК являются основными возбуждающими и тормозящими нейромедиаторами в головном мозге. Их баланс необходим для правильного развития и функционирования мозга. В этом исследовании учёные изучали роль генетики глутамата и ГАМК в тяжести СДВГ, выраженности симптомов аутизма и эффективности торможения, основываясь на анализе набора генов – подходе к одновременному изучению нескольких генетических вариантов. Данное исследование подтверждает гипотезу о том, что гены, участвующие в нейротрансмиссии глутамата, вовлечены в генезис СДВГ, поскольку они связаны с выраженностью гиперактивности и импульсивности. Общая черта для СДВГ и РАС – измененное ингибирование реакции – может свидетельствовать о связи с ГАМК; однако для выяснения этого необходимы дополнительные исследования.
Электроэнцефалография в исследовании взаимосвязи СДВГ и РАС
Электроэнцефалография — это способ изучения электрической активности мозга. Сейчас учёные полагают, что метод ЭЭГ (Электроэнцефалографии) может пролить свет на биологическую природу аутизма и СДВГ.
Статья «Насколько полезна электроэнцефалография в диагностике расстройств аутистического спектра и разграничении подтипов: систематический обзор» [15], вышедшая в 2017 году даёт представление о применении ЭЭГ для диагностики аутизма. В ней говорится: «Считается, что расстройства аутистического спектра (РАС) связаны с аномальными нейронными связями. В настоящее время нейронная связь – это теоретическая конструкция, которую нелегко измерить. Исследования в области сетевого анализа и анализа временных рядов показывают, что структура нейронной сети, маркер нейронной активности, может быть измерена с помощью электроэнцефалографии (ЭЭГ). ЭЭГ может быть количественно оценена с помощью различных методов анализа для потенциального выявления аномалий головного мозга… Мы провели обзор литературы, в котором было идентифицировано 40 исследований и классифицировано в соответствии с основным методом анализа ЭЭГ по трем категориям: анализ функциональной связности, анализ спектральной мощности и информационная динамика. Все исследования выявили существенные различия между пациентами с РАС и субъектами, не страдающими РАС. Однако из-за высокой неоднородности результатов обобщения сделать не удалось, и ни один из методов сам по себе в настоящее время не является полезным в качестве нового диагностического инструмента».

В 2018 году было проведено очень многообещающее исследование диагностики аутизма при помощи ЭЭГ. Учёные из Бостонского университета и Университета Сан-Франциско [16] изучали, может ли метод ЭЭГ использоваться с достоверностью для ранней диагностики РАС. Они отобрали 99 девять детей, чьи братья или сёстры имели РАС (группа высокого риска) и 89 детей без близких родственников с РАС (группа малого риска). Дети исследовались с 3 до 36 месяцев возраста. В конце исследования трое детей из группы малого риска и 32 ребёнка из группы высокого риска были диагностированы РАС. Дети несколько раз за время исследования проходили ЭЭГ и опросник (ADOS) для выявления РАС. Учёные анализировали различные особенности данных ЭКГ для создания алгоритма предсказания диагноза. Они пришли к выводу, что алгоритм оказался очень достоверным в предсказании выявления аутизма уже в раннем возрасте. Алгоритм показал 100% специфичность и чувствительность в диапазоне 82-100% при разграничении детей, позже диагностированных РАС, от детей из группы низкого риска. Важно также отметить, что алгоритм хорошо себя показал и при различении детей с РАС и детей из группы высокого риска. Но это оказалось сложнее сделать, так как данные ЭЭГ в этом случае были больше похожи на ЭЭГ аутичных детей. Но всё-таки недостаточно для постановки диагноза. Более того, ЭЭГ смог предсказать степень выраженности аутизма у детей.
Чувствительность и специфичность — статистические показатели диагностического теста по выявлению больных и здоровых, выводимых из ошибок первого и второго рода в бинарной классификации. Значения обоих показателей лежат в пределах от 0 до 1.
Чувствительность (истинно положительная пропорция) отражает долю положительных результатов, которые правильно идентифицированы как таковые. Иными словами, чувствительность диагностического теста показывает вероятность того, что больной субъект будет классифицирован именно как больной. Специфичность (истинно отрицательная пропорция) отражает долю отрицательных результатов, которые правильно идентифицированы как таковые, то есть вероятность того, что не больные субъекты будут классифицированы именно как не больные.- Википедия
Подобный крупный обзор вышел и в отношении СДВГ. В прошлом году появилась статья «Может ли электроэнцефалография (ЭЭГ) выявить подтипы СДВГ? Систематический обзор» [17]. В ней говорится: «СДВГ был ассоциирован с атипичными паттернами нейронной активности по данным электроэнцефалографии (ЭЭГ). Однако, определение диагностических биомаркеров по ЭЭГ осложняется гетерогенностью расстройства». А также: «ключевые показатели, которые показывают перспективность для распознавания существующих подтипов СДВГ и симптоматики, включают: состояния покоя и модуляцию альфа, бета и тета мощности, N2 и P3 компоненты». Здесь стоит отметить, что атипичность показателей альфа, дельта, тета, бета и гамма-активности была выявлена и для РАС [18].

В 2020-ом году был проведен систематический обзор исследований применения ЭЭГ для диагностики СДВГ: «ЭЭГ для диагностики СДВГ у взрослых: Систематический обзор с описательной частью» [19]. Было изучено 21 исследование со средним количеством участников в 34 человека (без контрольной группы). Крупнейшее исследование включало 309 участников, а самое маленькое — 14. Большинство исследований были хорошего качества. По данным исследований, включенных в этот обзор, были получены доказательства повышенных уровней как абсолютной, так и относительной тета-мощности и альфа-активности, наряду с общим снижением нейронной активности при выполнении задач, требующих внимания, у взрослых с СДВГ. Не было выявлено очевидных различий в дельта- или бета-активности. Однако авторы делают вывод, что в исследованиях есть противоречия и метод ЭЭГ ещё рано рекомендовать для точной диагностики.
В 2018 году было проведено исследование о взаимосвязи РАС и СДВГ под названием [20]: «Совпадения и различия между синдромом дефицита внимания и гиперактивности и расстройством аутистического спектра в молодом взрослом возрасте: систематический обзор и руководящие принципы для ЭЭГ-исследований». Всего было изучено 75 исследований с 2000 года. Авторы исследования отмечают, что и СДВГ, и РАС были отмечены, как имеющие связь с атипичным распределением ресурсов внимания и атипичным мониторингом деятельности, но существуют также атипичные аспекты обработки информации, специфичные для каждого отдельного расстройства.

При СДВГ значительная часть атипичных процессов в области внимания связана с ориентацией на сигналы, говорящие о подготовке ответа, в то время как при расстройствах аутистического спектра она более специфична для новизны, что может быть обусловлено, по крайней мере, частично, повышенной перцептивной способностью (и повышенной сохранностью визуальных стимулов в рабочей памяти). СДВГ может быть связан с нетипичным мониторингом конфликта и полезной обратной связи, в то время как РАС связано с нетипичной обработкой обратной связи, включающей социально значимые стимулы. Кроме того, СДВГ также был связан со снижением тормозной реакции, который непосредственно не изучался при РАС в молодом возрасте. Как СДВГ, так и РАС также были связаны с нетипичной обработкой лиц и атипичной ранней сенсорной обработкой как в зрительной, так и в слуховой областях. Однако профили, специфичные для конкретного расстройства, могут квалифицировать каждое расстройство. При РАС доказательства атипичной обработки лица неоднозначны, по крайней мере в молодом возрасте, и могут зависеть от качества саморелевантности стимулов, тогда как при СДВГ атипичная обработка может быть специфична для эмоций гнева. Различные исследования показали, что при РАС атипичная сенсорная обработка способствует “позднему” когнитивному дефициту, такому как обработка лиц и внимания. Некоторые области были изучены исключительно для РАС, поэтому требуются прямые сравнения с СДВГ, включая доказательства нетипичной языковой/семантической обработки и данные по нетипичной обработке имитации. В конце труда приведена сводная таблица, выявленных атипичных показателей ЭЭГ при РАС и СДВГ. К сожалению, в ней много пустых мест, так как многие области ещё недостаточно изучены для каждого расстройства.
Исследования с использованием МРТ
Метод магнитно-резонансной томографии произвёл целую революцию в медицине, позволив с высокой точностью исследовать внутренние органы и ткани человека. В последние годы для исследования данных, полученных при помощи МРТ и других методов диагностики, всё чаще используется искусственный интеллект, который позволяет выявлять закономерности, которые упустил бы человек.
В 2018 году вышло исследование «Использование функциональной МРТ в состоянии покоя для создания персонализированной системы диагностики аутизма» [21], в нём подчёркивается важность феномена связности в мозге. В работе говорится о том, что по результатам генетических исследований есть данные о связи мутаций в вовлеченных в синаптическую передачу белках с частотой развития аутизма. Важной аномалией связности, которая была обнаружена в белом веществе аутичных субъектов, является снижение связности на большие расстояния и увеличение связности на короткие и средние расстояния. Другие исследования также говорят об аномальной связности в регионах мозга, отвечающих за социальное взаимодействие.
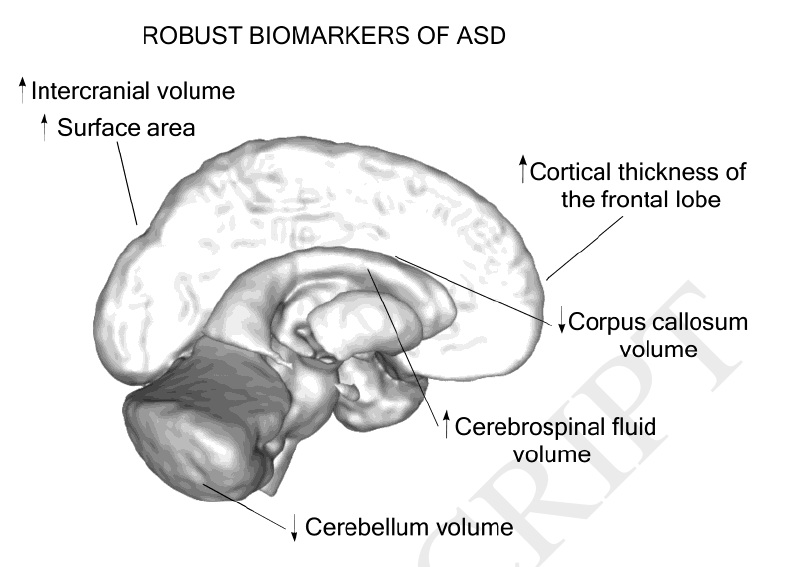
Ранее, в 2017 году было проведено исследование «Возможные биомаркеры у детей с расстройствами аутистического спектра: обзор исследований МРТ» [22], а в 2018 году – «Систематический обзор структурных биомаркеров МРТ при расстройствах аутистического спектра: перспектива машинного обучения» [23]. Эти исследования обобщили опыт больше сотни других раннее проведенных работ по анализу структурных особенностей мозга при РАС. Учёные выделяют следующие особенности: увеличение объема мозга в возрасте до 6 лет, увеличение объема лобной и височной долей, увеличение толщины коры в лобной доле, увеличение площади поверхности и кортикальной складчатости мозга, увеличение объема ликвора, также различия коснулись объема гиппокампа, миндалевидного тела, базальных ганглиев и таламуса.
Совсем недавно, в 2022 году вышел систематический обзор «Микроструктура белого вещества у детей и подростков с СДВГ» [24]. Было изучено 46 исследований, посвящённых анализу белого вещества по данным МРТ. Результаты этого систематического обзора говорят о широком распространении нарушений микроструктуры белого вещества у детей и подростков с СДВГ. Выявлена нетипичная организация белого вещества, с наиболее заметными проявлениями в лобно-стриатальных трактах, мозолистом теле, верхнем продольном пучке, поясном пучке, таламических излучениях, внутренней капсуле и лучевой короне. С точки зрения структуры нейрональных связей учёные предполагают глобальную недостаточную связность в соединениях между функционально специализированными сетями, а также региональное снижение сетевой эффективности в лобной и теменной долях, стриатуме, затылочной областях и мозжечке. Однако в некоторых участках белого вещества наоборот сообщалось о повышенной связности.
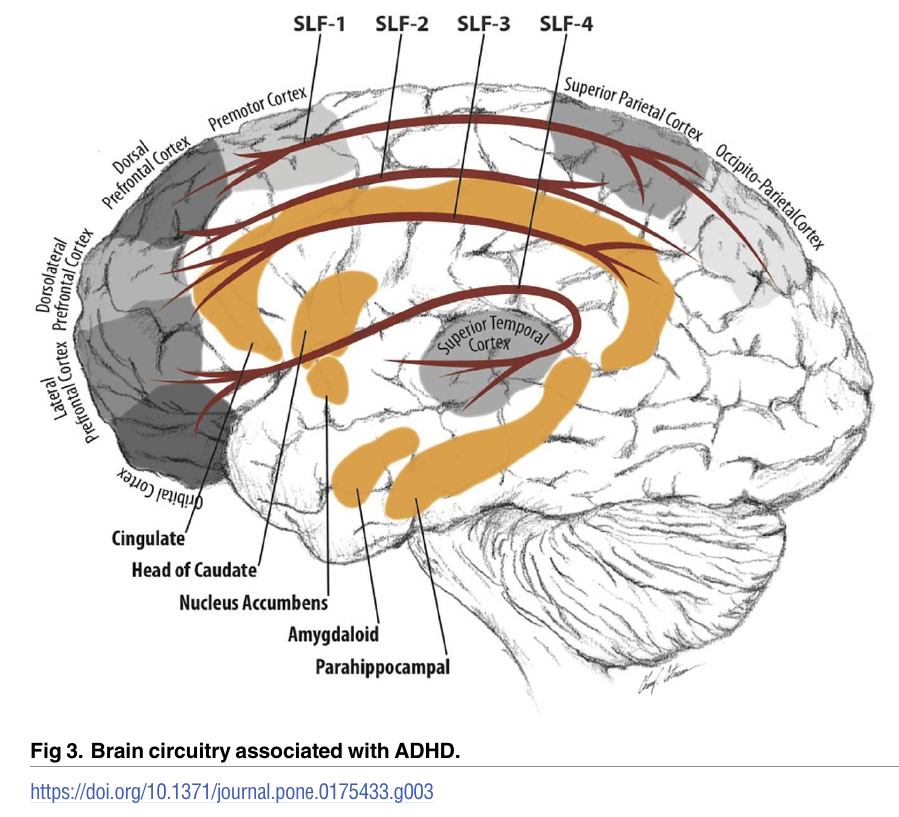
В 2017 году вышла работа «Анатомия мозга у молодых людей с СДВГ – исследование с помощью магнитно-резонансной томографии». Было изучено 72 участника (31 участник с СДВГ и 41 в контрольной группе) [25]. Диагноз СДВГ был связан с аномальной концентрацией серого и белого вещества. Результаты показали: 1. области с уменьшенным количеством серого вещества в правой средней и нижней лобной извилинах, правой верхней и средней височной извилинах, левой части хвостатого ядра головы и левой парагиппо-кампальной извилине 2. области с увеличенным количеством белого вещества в правой лобной извилине, правой нижней лобной извилине, правой средней височной извилине, левой и правой наружных капсулах, левой внутренней капсулы и левая парагиппокампальной извилины.
В работе 2021 года «Нейровизуализация при синдроме дефицита внимания/гиперактивности: Последние достижения» [26] говорится: исследования мозга пациентов с СДВГ показывают общее уменьшение объема серого вещества, которое чаще всего происходит в лобных долях, а также большую тяжесть симптомов у пациентов с меньшим объемом серого вещества в лобных и височных долях.
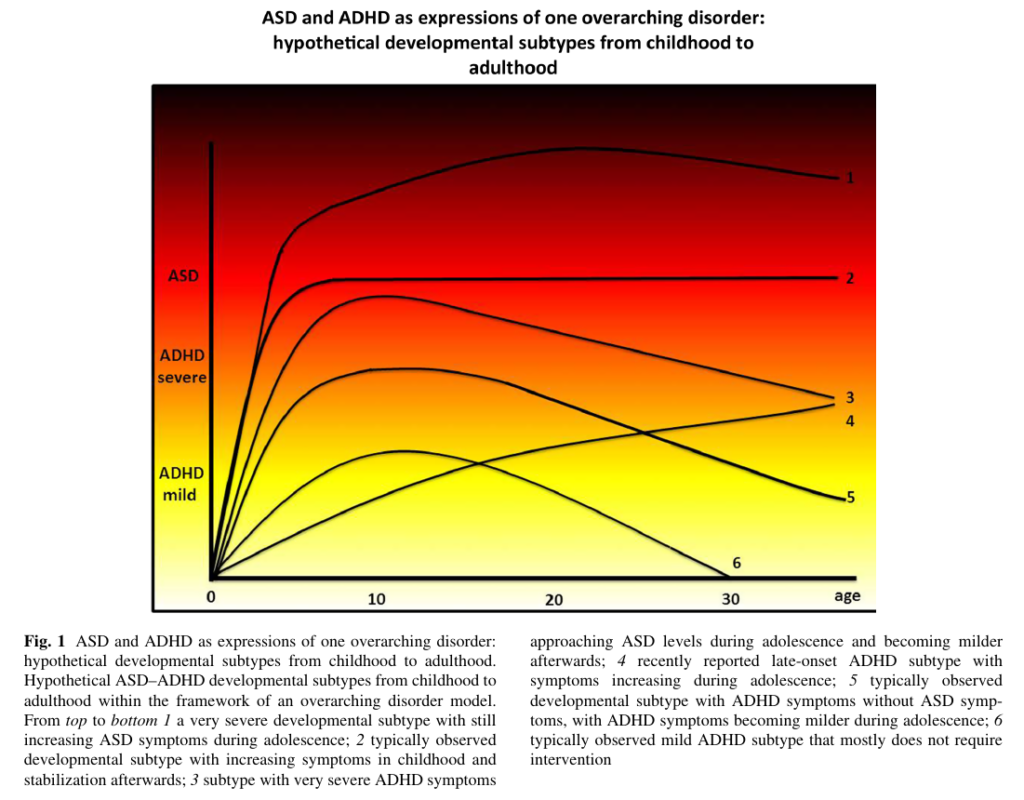
А авторы исследования «Корреляты РАС и СДВГ на протяжении жизни при структурной визуализации мозга: гипотезообразующий обзор возрастных подтипов СДВГ-РАС» [27], которое вышло в 2016 году выдвигают гипотезу существования комплексного (overarching) расстройства РАС-СДВГ, в котором выделяют шесть подтипов по тяжести и изменениям при взрослении (см. картинку выше). По мнению этих учёных ключевой отличительной чертой этих расстройств и подтипов могут быть различные возрастные изменения (истончение) передней поясной извилины коры головного мозга и прилегающих к ней связей с другими префронтальными областями. Эти зоны чрезвычайно важны для когнитивного и волевого контроля, а также социо-эмоционального развития.
Взаимосвязь РАС и СДВГ. Единое расстройство?
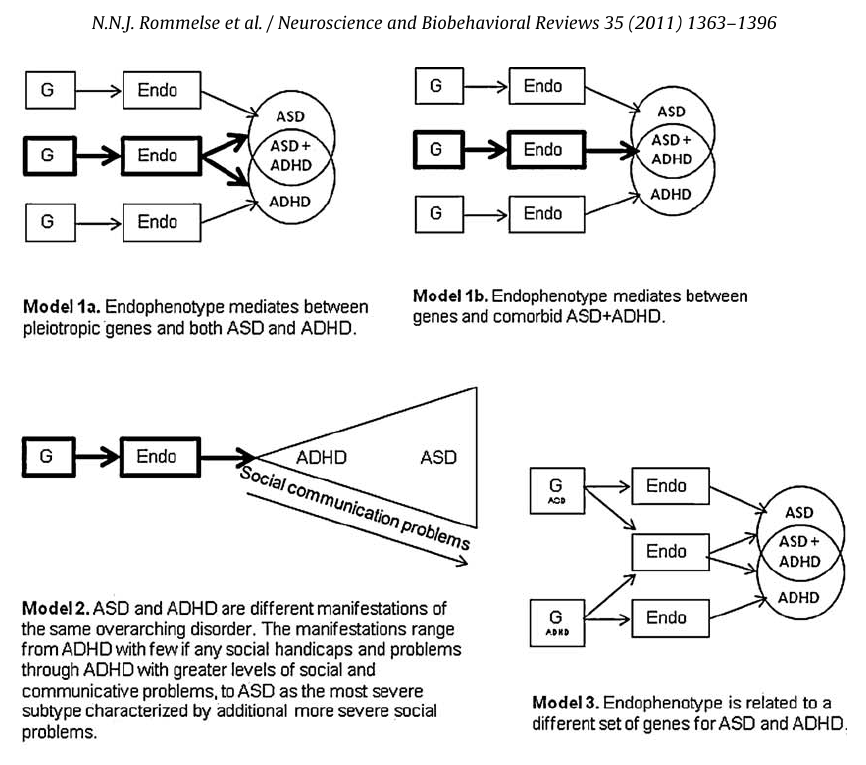
Одними из первых заговорили о необходимости детально исследовать взаимосвязь и пересечение СДВГ и РАС авторы исследования «Общая наследуемость синдрома дефицита внимания и гиперактивности и расстройств аутистического спектра» [28]. Это исследование вышло в 2010 году, ещё до принятия DSM-V. В нём они пишут, что «исследования близнецов показывают, что 50–72% фенотипической вариативности могут быть связаны с общими [для двух расстройств] аддитивными генетическими факторами». В следующем году коллектив тех же авторов выпустил ещё одну работу «Обзор когнитивных и мозговых эндофенотипов, которые могут быть распространены при РАС и СДВГ и облегчают поиск плейотропных генов» [29]. В этой работе они представили целых десять различных моделей взаимодействия генов и эндофенотипов РАС и СДВГ. Эндофенотип — промежуточная особенность, лежащая на полпути между генетическими предпосылками сложного заболевания и собственно комплексом симптомов.
В своём труде авторы делают вывод, что в дополнение к определенным эндофенотипическим признакам, которые уникальны для РАС и СДВГ, существуют эндофенотипические признаки, которые опосредуют связь между определенными генами риска, с одной стороны, и как РАС, так и СДВГ, с другой стороны (модель 1а (см. картинку ниже)) или однозначно опосредуют связь между определенными генами и только массивом РАС + СДВГ (модель 1b). Интригующей является модель 2, в которой РАС и СДВГ на самом деле являются разными проявлениями одного и того же широкого расстройства. Проявления которого варьируются от СДВГ с небольшим количеством социальных проблем, если таковые вообще имеются, до СДВГ с большим уровнем социальных и коммуникативных проблем, и до РАС как наиболее тяжелого подтипа, характеризующегося дополнительными, более серьезными социальными проблемами. Таким образом, с этой точки зрения СДВГ можно рассматривать как легкий подтип с меньшими нарушениями в рамках более тяжелого спектра РАС. Такая нозологическая модель предполагала бы, что генетической основой СДВГ и РАС + СДВГ являются либо в значительной степени схожие гены (разница в тяжести между ними обусловлена главным образом факторами окружающей среды), либо гены вовлеченные в СДВГ, являются подмножеством генов, вовлеченных в РАС (причем разница в тяжести объясняется дополнительными аллелями риска для РАС и их взаимодействием с факторами окружающей среды). Степень уникальных и пересекающихся причинных факторов РАС и СДВГ неясна. Эндофенотипические данные, по-видимому, наиболее согласуются с моделью 2. Однако в настоящее время преждевременно делать вывод о том, что СДВГ не имеет уникальных причинных факторов, и отвергать модель 1а. Однако авторы не исключают вероятность правильности и других моделей. И указывают на необходимость дальнейших исследований.
В 2012 появляется работа «Являются ли расстройства аутистического спектра и синдром дефицита внимания/гиперактивности разными проявлениями одного всеобъемлющего расстройства? Когнитивные данные и данные о симптомах на основе клинической и популяционной выборки» [30]. В рамках данного ислледования было изучено 644 ребёнка и подростка. В этом исследовании изучалось, существуют ли различные классы симптомов РАС-СДВГ и подтверждает ли их совпадение или различие в ассоциированных признаках (сопутствующих симптомах и когнитивных функциях) гипотезу градиентного всеобъемлющего расстройства или гипотезу отдельных расстройств. Если гипотеза о градиентном всеобъемлющем расстройстве верна, анализ идентифицировал бы по крайней мере один класс СДВГ без симптомов РАС или только с незначительными симптомами РАС, и ни одного класса РАС без симптомов СДВГ. Это именно то, что нашли учёные. От двух нормальных классов можно отличить три класса пациентов: один класс только с симптомами СДВГ, один класс с клиническими уровнями СДВГ, но также с клинически повышенными уровнями симптомов РАС (СДВГ [+РАС]) и один класс с клинически высокими уровнями симптомов РАС, но также с клинически повышенными уровнями симптомов СДВГ (РАС[+СДВГ]). Как и предполагалось, не было выявлено ни одного класса с исключительными симптомами РАС; все дети, у которых проявлялось аутичное поведение, также демонстрировали прекурсор поведения с СДВГ. Этот вывод согласуется с более высокой распространенностью детей с РАС, которые соответствуют критериям СДВГ (до 80% в литературе), по сравнению с частотой РАС у детей с СДВГ (до 50% как в литературе, так и в нашей выборке).
В 2015 году выходит статья «Являются ли РАС и СДВГ континуумом? Сравнение патофизиологических сходств между расстройствами» [31]. Я о ней уже писал, тут по сути повтор. В ней отмечается, что аутистам тоже часто свойственны черты, приписываемые СДВГ, например, невнимательность, а отдельные исследования говорят, что до 85% детей с СДВГ испытывают проблемы в коммуникации со сверстниками, как и дети с РАС. Помимо основных свойств данных расстройств у детей с РАС и СДВГ отмечается также схожесть и других сопутствующих проявлений. Схожесть наблюдается в проблемах с сенсорной обработкой информации, исполнительной функцией, теорией разума, самоконтролем, моторикой, нарушениями сна и тревожностью.
В статье разбирается каждый из этих симптомов. Расстройства сенсорной обработки заключаются в нарушении обработки сенсорных стимулов и реагировании на них. Это нарушения в обнаружении и интерпретации стимулов. Данные нарушения не являются ключевыми при постановке диагноза аутизма, но они встречаются, по определённым данным, у 90% процентов детей с РАС (Geschwind, 2009). Эти нарушения могут быть тактильными, визуальными, слуховыми, вестибулярными и другими. Таких точных данных по СДВГ в статье не приводится. Однако одно из исследований показало что группа мальчиков с СДВГ, которую сверяли с нейротипичными детьми, имела особенности тактильной сенсорики ((Parush, Sohmer, Steinberg, and Kaitz (2007)). Авторы также ссылаются на исследование особенностей нарушения сенсорной обработки у детей с СДВГ и РАС, которое показало отсутствие крупных различий между проблемами детей с СДВГ и РАС (Cheung and Siu (2009)).
Теория разума (ТР) это термин означающий набор интеллектуальных способностей, что позволяют нам понимать, что у других могут быть свои убеждения, желания и намерения, которые отличаются от наших. Исполнительная функция (ИФ) это совокупность процессов, которые позволяют управлять собой и своими ресурсами для достижения целей. Это зонтичный термин для навыков, включающих в себя ментальный контроль и саморегуляцию. Данные показывают, что проблемы с ТР и ИФ есть как у детей с РАС, так и у детей с СДВГ. Отдельные исследования показывают, что в своих проявлениях данные проблемы схожи у данных групп детей, а различия между ними носят скорее количественный, а не качественный характер (Rommelse, Geurts, Franke, Buitelaar, and Hartman (2011)).

Самоконтроль, способность к саморегуляции, нарушены у детей с СДВГ. Исследование, которое цитируют авторы, показало, что тесты на самоконтроль позволяют хорошо разграничить нормально развивающихся детей от детей с РАС и СДВГ (Samyn et al. (2011)). Но они плохо способствуют нахождению различий в этой проблеме у самих детей с РАС и СДВГ.
Проблемы с моторикой также часто встречаются в случаях наличия у ребёнка РАС или СДВГ ((Reiersen & Todd, 2008; Fliers et al., 2012). Это могут быть проблемы с мелкой и крупной моторикой, нарушения двигательных навыков, мышечная слабость, сложность в поддержании равновесия и другие. Более того, дети с СДВГ с выраженными проблемами с моторикой чаще проявляют симптомы РАС.
Многие исследования показали, что РАС часто сопровождаются тревожностью. По некоторым данным 39.6% молодых людей с РАС имеют коморбидное тревожное расстройство (van Steensel, Bögels, and Perrin (2011)). Проблемы с тревогой также наблюдаются у детей с СДВГ. Для обеих групп детей характерны проблемы со сном. Подчёркивается, что по заключениям некоторых исследований 73% опрошенных родителей и опекунов говорят о проблемах со сном у своих детей с СДВГ (O’Laughlin, and Brubaker (2011)).
Статья в дальнейшем посвящена общности метаболических и эндокринных проблем при наличии РАС или СДВГ. В частности это окислительный стресс, снижение метилирования и гормональные нарушения. Разделы посвящённые этим темам содержат большое количество информации, затрагивающей биологические, электрические и химические процессы в деталях, которые сложно понять человеку без профильного образования. Достаточно сказать, что авторы показывают схожесть данных проблем у детей с РАС и СДВГ.

Следующий раздел авторы посвящают влиянию токсичных металлов на развитие детей с СДВГ и РАС. Есть много свидетельств того, что обнаружение наличия токсичных металлов в организме ребёнка коррелирует с наличием СДВГ и РАС. Один из факторов роста числа детей с данными расстройствами возможно связан с изменениями в окружающей среде, которые ведут к контакту с частицами ртути и свинца, а также других металлов.
Последний основной раздел статьи посвящён сходству между патологиями головного мозга в случаях РАС и СДВГ. При помощи средств позитронно-эмиссионной томографии, а также других современных технологий было выявлено, что люди с РАС и СДВГ чаще страдают от гипоперфузий головного мозга, то есть снижения регионального мозгового кровотока. Авторы указывают на то, что как в случае РАС, так и СДВГ, часто наблюдается потеря критически важных нейронных связей. Было высказано предположение, что аномальная связность, ограниченные соединения и ограниченная способность кортикальных сетей координировать обработку информации имеют решающее значение при обоих расстройствах, подразумевая дефицит интеграции информации на нервном и когнитивном уровнях. В некоторых же случаях бывает локальная избыточная связь в некоторых регионах мозга (Wass (2011)). Патология обоих расстройств включает потерю соединений дальнего действия и увеличение соединений ближнего действия. Также часто у людей с СДВГ и РАС в мозгу наблюдается аномальная гамма-активность.

В заключении авторы делают вывод, что РАС и СДВГ имеют много схожих характеристик, что убедительно свидетельствует о том, что эти два неврологических состояния отражают аномальную функцию общих нейрохимических путей и путей развития нервной системы. Характерные общие черты включают недавнее увеличение распространенности, преобладание расстройств у мужского пола, роль окислительного стресса и нарушения метилирования в мозге, гипоперфузию мозга, аномальную нейронную связь и аномальную синхронизацию. Краткое описание сходств между РАС и СДВГ представлено у авторов в виде таблицы. Предполагается, что СДВГ и РАС, из-за множественных сходств в патологии головного мозга и симптоматике, следует рассматривать как родственные состояния, которые относятся к одному континууму.
В 2019 году итальянскими учёными была выпущена статья «Континиум нейроразвития на пути гипотезе градиента нейроразвития» [32]. Авторы статьи считают, что в отличие от категориального подхода современной нозографической системы, в последние десятилетия все больше литературы предполагает, что психические расстройства могут быть лучше концептуализированы как континуум, общей основой которого были бы изменения в развитии нервной системы. “Континуум нейроразвития” (NC) – это теоретическая схема, подкрепленная несколькими эмпирическими доказательствами в различных областях исследований. Концептуальная основа этой модели заключается в том, что изменения в развитии мозга, проявление которых будет определяться взаимосвязанными отношениями между генетическими факторами и факторами окружающей среды, могут составлять общую основу различных видов психических расстройств. Более того, теория NC также подразумевает, что психические состояния могут быть расположены по градиенту, где расстройство аутистического спектра (ASD) с нарушениями интеллекта было бы наиболее серьезным выражением изменения “социального мозга”, за которым следовали бы другие фенотипы развития нервной системы DSM-5, характеризующиеся более легкими нарушениями.

Дальше эта модель включала бы, по убывающему градиенту развития нервной системы, другие психические состояния, такие как шизофрения и расстройства настроения, а также расстройства пищевого поведения и тревожные расстройства, охватывающие также непсихопатологические черты личности. С когнитивной точки зрения, связь между изменениями в развитии нервной системы и уязвимостью к психопатологии может быть выявлена в нарушении проприоцептивного опыта и интероцептивного вывода, что помешали пациенту должным образом определить свою собственную субъектность и адекватно разместить себя в пространстве отношений.
Заключение
Последние годы начали появляться труды, посвящённые именно проверке гипотезы того, что РАС и СДВГ образуют единый спектр. Авторы исследования «Расстройства аутистического спектра и СДВГ: пересекающаяся феноменология, диагностические вопросы и аспекты лечения» 2019-ого года считают, что накопленная база знаний позволяет предположить, что РАС и СДВГ являются взаимосвязанными состояниями, но в то же время достаточно различными, чтобы считаться отдельными расстройствами [33]. Используя аналогию, они рассматривают РАС и СДВГ «как “двоюродных братьев” друг другу, возможно, даже как родных сестер». Но не полагают, что «РАС и СДВГ следует считать близнецами»».
В 2022 году вышла работа «Исследование всеобъемлющей теории континуума: фенотипическая кластеризация детей с РАС или СДВГ на основе данных», в которой учёные пишут, что «наши результаты показывают, что РАС и СДВГ нельзя однозначно охарактеризовать ни как две отдельные клинические формы, ни как противоположные концы одного спектра, и подчеркивают необходимость изучения черт СДВГ и РАС в тандеме» [34].
Можно сказать, что СДВГ и РАС являются близкими расстройствами, но пока нельзя однозначно сказать являются ли они подтипами одного единого расстройства.

Список литературы
1 – https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5834391/pdf/nihms937906.pdf
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC9616454/
2. https://www.cdc.gov/ncbddd/adhd/timeline.html
3. https://www.cdc.gov/ncbddd/autism/data.html
4. Antshel KM, Russo N. Autism Spectrum Disorders and ADHD: Overlapping Phenomenology, Diagnostic Issues, and Treatment Considerations. Curr Psychiatry Rep. 2019 Mar 22;21(5):34. doi: 10.1007/s11920-019-1020-5. PMID: 30903299.
5. Mulligan A, Anney RJ, O’Regan M, Chen W, Butler L, Fitzgerald M, Buitelaar J, Steinhausen HC, Rothenberger A, Minderaa R, Nijmeijer J, Hoekstra PJ, Oades RD, Roeyers H, Buschgens C, Christiansen H, Franke B, Gabriels I, Hartman C, Kuntsi J, Marco R, Meidad S, Mueller U, Psychogiou L, Rommelse N, Thompson M, Uebel H, Banaschewski T, Ebstein R, Eisenberg J, Manor I, Miranda A, Mulas F, Sergeant J, Sonuga-Barke E, Asherson P, Faraone SV, Gill M. Autism symptoms in Attention-Deficit/Hyperactivity Disorder: a familial trait which correlates with conduct, oppositional defiant, language and motor disorders. J Autism Dev Disord. 2009 Feb;39(2):197-209. doi: 10.1007/s10803-008-0621-3. Epub 2008 Jul 19. Erratum in: J Autism Dev Disord. 2009 Feb;39(2):210-1. PMID: 18642069.
6. Kern JK, Geier DA, Sykes LK, Geier MR, Deth RC. Are ASD and ADHD a Continuum? A Comparison of Pathophysiological Similarities Between the Disorders. J Atten Disord. 2015 Sep;19(9):805-27. doi: 10.1177/1087054712459886. Epub 2012 Oct 16. PMID: 23074304.
7. Woodbury-Smith M, Scherer SW. Progress in the genetics of autism spectrum disorder. Dev Med Child Neurol. 2018 May;60(5):445-451. doi: 10.1111/dmcn.13717. Epub 2018 Mar 25. PMID: 29574884.
8. Thapar A, Rutter M. Genetic Advances in Autism. J Autism Dev Disord. 2021 Dec;51(12):4321-4332. doi: 10.1007/s10803-020-04685-z. PMID: 32940822; PMCID: PMC8531042.
9. Bai D, Yip BHK, Windham GC, Sourander A, Francis R, Yoffe R, Glasson E, Mahjani B, Suominen A, Leonard H, Gissler M, Buxbaum JD, Wong K, Schendel D, Kodesh A, Breshnahan M, Levine SZ, Parner ET, Hansen SN, Hultman C, Reichenberg A, Sandin S. Association of Genetic and Environmental Factors With Autism in a 5-Country Cohort. JAMA Psychiatry. 2019 Oct 1;76(10):1035-1043. doi: 10.1001/jamapsychiatry.2019.1411. PMID: 31314057; PMCID: PMC6646998.
10. Thapar A. Discoveries on the Genetics of ADHD in the 21st Century: New Findings and Their Implications. Am J Psychiatry. 2018 Oct 1;175(10):943-950. doi: 10.1176/appi.ajp.2018.18040383. Epub 2018 Aug 16. PMID: 30111187.
11. Mariggiò MA, Palumbi R, Vinella A, Laterza R, Petruzzelli MG, Peschechera A, Gabellone A, Gentile O, Vincenti A, Margari L. DRD1 and DRD2 Receptor Polymorphisms: Genetic Neuromodulation of the Dopaminergic System as a Risk Factor for ASD, ADHD and ASD/ADHD Overlap. Front Neurosci. 2021 Sep 29;15:705890. doi: 10.3389/fnins.2021.705890. PMID: 34658761; PMCID: PMC8511701.
12. Ma SL, Chen LH, Lee CC, Lai KYC, Hung SF, Tang CP, Ho TP, Shea C, Mo F, Mak TSH, Sham PC, Leung PWL. Genetic Overlap Between Attention Deficit/Hyperactivity Disorder and Autism Spectrum Disorder in SHANK2 Gene. Front Neurosci. 2021 Apr 27;15:649588. doi: 10.3389/fnins.2021.649588. PMID: 33986640; PMCID: PMC8111170.
13. Martin J, Cooper M, Hamshere ML, Pocklington A, Scherer SW, Kent L, Gill M, Owen MJ, Williams N, O’Donovan MC, Thapar A, Holmans P. Biological overlap of attention-deficit/hyperactivity disorder and autism spectrum disorder: evidence from copy number variants. J Am Acad Child Adolesc Psychiatry. 2014 Jul;53(7):761-70.e26. doi: 10.1016/j.jaac.2014.03.004. Epub 2014 Apr 21. PMID: 24954825; PMCID: PMC4074351.
14. Naaijen J, Bralten J, Poelmans G; IMAGE consortium; Glennon JC, Franke B, Buitelaar JK. Glutamatergic and GABAergic gene sets in attention-deficit/hyperactivity disorder: association to overlapping traits in ADHD and autism. Transl Psychiatry. 2017 Jan 10;7(1):e999. doi: 10.1038/tp.2016.273. PMID: 28072412; PMCID: PMC5545734.
15. Gurau O, Bosl WJ, Newton CR. How Useful Is Electroencephalography in the Diagnosis of Autism Spectrum Disorders and the Delineation of Subtypes: A Systematic Review. Front Psychiatry. 2017 Jul 12;8:121. doi: 10.3389/fpsyt.2017.00121. PMID: 28747892; PMCID: PMC5506073.
16. O’Neill M, Shear T. EEG for Diagnosis of Autism Spectrum Disorder. Pediatr Neurol Briefs. 2018 Nov 9;32:13. doi: 10.15844/pedneurbriefs-32-13. PMID: 30505136; PMCID: PMC6224325.
17. Slater J, Joober R, Koborsy BL, Mitchell S, Sahlas E, Palmer C. Can electroencephalography (EEG) identify ADHD subtypes? A systematic review. Neurosci Biobehav Rev. 2022 Aug;139:104752. doi: 10.1016/j.neubiorev.2022.104752. Epub 2022 Jun 26. PMID: 35760387.
18. Precenzano F, Parisi L, Lanzara V, Vetri L, Operto FF, Pastorino GMG, Ruberto M, Messina G, Risoleo MC, Santoro C, Bitetti I, Marotta R. Electroencephalographic Abnormalities in Autism Spectrum Disorder: Characteristics and Therapeutic Implications. Medicina (Kaunas). 2020 Aug 19;56(9):419. doi: 10.3390/medicina56090419. PMID: 32825169; PMCID: PMC7559692.
19. Adamou M, Fullen T, Jones SL. EEG for Diagnosis of Adult ADHD: A Systematic Review With Narrative Analysis. Front Psychiatry. 2020 Aug 25;11:871. doi: 10.3389/fpsyt.2020.00871. PMID: 33192633; PMCID: PMC7477352.
20. Lau-Zhu A, Fritz A, McLoughlin G. Overlaps and distinctions between attention deficit/hyperactivity disorder and autism spectrum disorder in young adulthood: Systematic review and guiding framework for EEG-imaging research. Neurosci Biobehav Rev. 2019 Jan;96:93-115. doi: 10.1016/j.neubiorev.2018.10.009. Epub 2018 Oct 24. PMID: 30367918; PMCID: PMC6331660.
21. Dekhil O, Hajjdiab H, Shalaby A, Ali MT, Ayinde B, Switala A, Elshamekh A, Ghazal M, Keynton R, Barnes G, El-Baz A. Using resting state functional MRI to build a personalized autism diagnosis system. PLoS One. 2018 Oct 31;13(10):e0206351. doi: 10.1371/journal.pone.0206351. PMID: 30379950; PMCID: PMC6209234.
22. Li D, Karnath HO, Xu X. Candidate Biomarkers in Children with Autism Spectrum Disorder: A Review of MRI Studies. Neurosci Bull. 2017 Apr;33(2):219-237. doi: 10.1007/s12264-017-0118-1. Epub 2017 Mar 10. PMID: 28283808; PMCID: PMC5360855.
23. Pagnozzi AM, Conti E, Calderoni S, Fripp J, Rose SE. A systematic review of structural MRI biomarkers in autism spectrum disorder: A machine learning perspective. Int J Dev Neurosci. 2018 Dec;71:68-82. doi: 10.1016/j.ijdevneu.2018.08.010. Epub 2018 Aug 30. PMID: 30172895.
24. Connaughton M, Whelan R, O’Hanlon E, McGrath J. White matter microstructure in children and adolescents with ADHD. Neuroimage Clin. 2022;33:102957. doi: 10.1016/j.nicl.2022.102957. Epub 2022 Feb 7. PMID: 35149304; PMCID: PMC8842077.
25. Gehricke JG, Kruggel F, Thampipop T, Alejo SD, Tatos E, Fallon J, Muftuler LT. The brain anatomy of attention-deficit/hyperactivity disorder in young adults – a magnetic resonance imaging study. PLoS One. 2017 Apr 13;12(4):e0175433. doi: 10.1371/journal.pone.0175433. PMID: 28406942; PMCID: PMC5391018.
26. Firouzabadi FD, Ramezanpour S, Firouzabadi MD, Yousem IJ, Puts NAJ, Yousem DM. Neuroimaging in Attention-Deficit/Hyperactivity Disorder: Recent Advances. AJR Am J Roentgenol. 2022 Feb;218(2):321-332. doi: 10.2214/AJR.21.26316. Epub 2021 Aug 18. PMID: 34406053.
27. Rommelse N, Buitelaar JK, Hartman CA. Structural brain imaging correlates of ASD and ADHD across the lifespan: a hypothesis-generating review on developmental ASD-ADHD subtypes. J Neural Transm (Vienna). 2017 Feb;124(2):259-271. doi: 10.1007/s00702-016-1651-1. Epub 2016 Dec 21. PMID: 28000020; PMCID: PMC5285408.
28. Rommelse NN, Franke B, Geurts HM, Hartman CA, Buitelaar JK. Shared heritability of attention-deficit/hyperactivity disorder and autism spectrum disorder. Eur Child Adolesc Psychiatry. 2010 Mar;19(3):281-95. doi: 10.1007/s00787-010-0092-x. Epub 2010 Feb 11. PMID: 20148275; PMCID: PMC2839489.
29. Rommelse NN, Geurts HM, Franke B, Buitelaar JK, Hartman CA. A review on cognitive and brain endophenotypes that may be common in autism spectrum disorder and attention-deficit/hyperactivity disorder and facilitate the search for pleiotropic genes. Neurosci Biobehav Rev. 2011 May;35(6):1363-96. doi: 10.1016/j.neubiorev.2011.02.015. Epub 2011 Mar 4. PMID: 21382410.
30. van der Meer JM, Oerlemans AM, van Steijn DJ, Lappenschaar MG, de Sonneville LM, Buitelaar JK, Rommelse NN. Are autism spectrum disorder and attention-deficit/hyperactivity disorder different manifestations of one overarching disorder? Cognitive and symptom evidence from a clinical and population-based sample. J Am Acad Child Adolesc Psychiatry. 2012 Nov;51(11):1160-1172.e3. doi: 10.1016/j.jaac.2012.08.024. Epub 2012 Sep 30. PMID: 23101742.
31. Kern JK, Geier DA, Sykes LK, Geier MR, Deth RC. Are ASD and ADHD a Continuum? A Comparison of Pathophysiological Similarities Between the Disorders. J Atten Disord. 2015 Sep;19(9):805-27. doi: 10.1177/1087054712459886. Epub 2012 Oct 16. PMID: 23074304.
32. L. Dell’Osso, P. Lorenzi, B. Carpita. The neurodevelopmental continuum towards a neurodevelopmental gradient hypothesis. Journal of Psychopathology 2019;25:179-82. https://old.jpsychopathol.it/wp-content/uploads/2019/12/00_Editorial_4_19-1.pdf
33. Antshel KM, Russo N. Autism Spectrum Disorders and ADHD: Overlapping Phenomenology, Diagnostic Issues, and Treatment Considerations. Curr Psychiatry Rep. 2019 Mar 22;21(5):34. doi: 10.1007/s11920-019-1020-5. PMID: 30903299.
34. Deserno MK, Bathelt J, Groenman AP, Geurts HM. Probing the overarching continuum theory: data-driven phenotypic clustering of children with ASD or ADHD. Eur Child Adolesc Psychiatry. 2023 Oct;32(10):1909-1923. doi: 10.1007/s00787-022-01986-9. Epub 2022 Jun 10. PMID: 35687205; PMCID: PMC10533623.
